制藥凍干機設備GMP驗證的步驟及內容!
一、 制藥裝備的驗證
《藥品生產質量管理規范(1998年修訂版)》關于第四章設備的要求摘抄如下:
第三十一條:設備設計、選型、安裝應符合生產要求,易于清洗、消毒或滅菌,便于生產操作和維修、保養,并能防止差錯和減少污染。
第三十二條:與藥品直接接觸的設備表面應光潔、平整、易清洗或消毒、耐腐蝕,不與藥品發生化學變化或吸附藥品。設備所用的潤滑劑、冷卻劑等不得對藥品或容器造成污染。
第三十三條:與設備連接的主要固定管道應標明管內物料名稱、流向。
第三十四條:純化水、注射用水的制備、儲存和分配應能防止微生物的滋生和污染。儲罐和輸送管道所用材料應無毒、耐腐蝕。管道的設計和安裝應避免死角、盲管。儲罐和管道要規定清洗、滅菌周期。注射用水儲罐的通氣口應安裝不脫落纖維的疏水性除菌濾器。注射用水的儲存可采用80℃以上保溫、65℃以上保溫循環或4℃以下存放。
第三十五條:用于生產和檢驗的儀器、儀表、量具、衡器等,其適用范圍和精密度應符合生產的檢驗要求,有明顯的合格標志,并定期校驗。
第三十六條:生產設備應有明顯的狀態標志,并定期維修、保養和驗證。設備安裝、維修、保養的操作不得影響產品的質量。不合格的設備如有可能應搬出生產區,未搬出前應有明顯標志。
第三十七條:生產、檢驗設備均應有使用、維修、保養記錄,并由專人管理。
制藥裝備主要圍繞以上七個方面展開實施驗證。對于驗證的信息可從國內、國外相關資料信息獲得。
如:《制藥企業GMP管理實用指南》鄧海根主編,中國計量出版社出版;
《藥品生產質量管理工程》(國家藥品監督局培訓中心組織編寫)朱世斌主編,化學工業出版社出版。
《藥品生產驗證指南》由國家醫藥管理局推行GMP、GSP委員會編,中國醫藥科技出版社出版。
《藥品GMP文件化教程》李鈞編著,朱世斌主審。中國醫藥科技出版社出版。
《無菌制藥工藝的驗證》【美】弗里德里克·卡利登、詹姆斯·艾蓋洛柯編,上海科學普及出版社出版。對制藥工藝驗證作了詳細介紹。與凍干機有關的驗證可參見對冷凍干燥工藝的驗證。
《制藥機械GMP技術(宣傳資料匯編)》由上海醫藥設計院,國家經貿委制藥機械技術中心站出版式,傳遞最新國內制藥機械GMP相關技術。
最新曰美歐關于凍干藥品無菌要求的規定:
1) EU-GMP Annex1 9/’03改定
2) ISO13408-1 Aseptic processing of health care products
3) FDA:Guidance for industry sterile drug products by asepitic processing(Draft)8/’03

二、凍干機驗證:
冷凍干燥技術因其具有在低溫度下進行干燥,對于許多熱敏物質不會發生變性或失去生物活力,且物質中的一些揮發性成份損失小;在干燥過程中微生物的生長和酶的作用幾乎不變,保持了原來的結構;干燥后的物質疏松多孔復水性好;制成品為干粉狀態,穩定性好,易于長期保存其有效成份。因此凍干技術在制藥企業得到廣泛應用。凍干機是凍干生產過程中的主要工藝裝備, 制品中的水分由它來去除。制品在凍干腔室內的無菌狀態下完成干燥、解吸,除去水分和全壓塞等操作。
由于藥物制品的多樣性,以及制造工藝過程的差異和一些行業的特殊要求,導致對制藥裝備有一些特別的要求。在這類要求中,尤其以藥品生產質量管理規范(GMP)最為突出。《制藥裝備實施GMP指南》中第三篇《制劑機械》,第四章《粉針劑械與設備》,第九節《冷凍干燥機》(作者西南藥業股份有限公司 錢應璞)中,圍繞凍干機怎樣來適應GMP規范的要求,及凍干機的驗證作了詳細介紹。
現有國內凍干機的驗證主要結合國內大型先進制藥廠、外資企業、藥機廠的經驗及進口凍干機的相關驗證經驗,再根據國際、國內的相關資料匯總成驗證方案實施驗證。
安裝確認、運行確認和性能確認一般由藥機廠和制藥廠共同完成。藥機廠通過運行確認,將凍干機調至適當的工作狀態,同時培訓了用戶的人員,制藥廠的人員則通過運行確認學習了操作、曰常維護保養的技巧并進行了驗收。
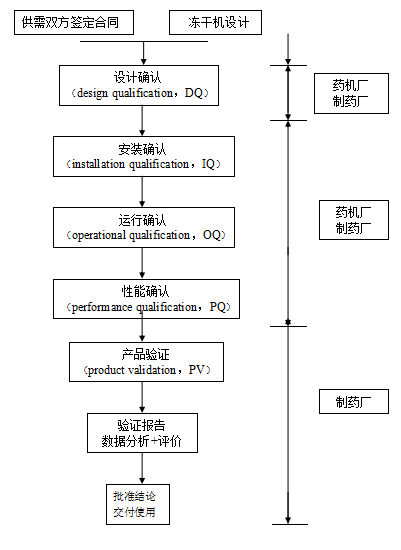
圖6-2凍干機驗證步驟
在此主要介紹凍干機驗證的設計確認(DQ)、安裝確認(IQ)、運行確認(OQ)、性能確認(PQ)四部分內容以供參考。
1)設計確認(DQ):通常指對項目設計方案的預審查。包括平面布局、水系統、凈化空調系統、待訂購設備對生產工藝適用性的審查,及對供應廠商的選定。設計確認被認為是項目及驗證的關鍵要素,因為設計方面的失誤往往會造成事后難以彌補的先天性缺陷。
對于制藥設備,由于品種多,且涉及專業面較廣,制藥廠不可能全掌握,所以一般設計確認采用兩種方式進行,一種對于特別熟悉的設備可將設計思想、理念、達到的標準要求、使用條件告知藥機廠,待設計好后由雙方對設備進行預確認。另一種對不熟悉的設備可將使用條件,要求達到的性能指標告知藥機廠,委托藥機廠設計確認。
設計凍干機時,首先要考慮到目的和要求,技術性能要有一定的先進性、滿足合同要求的各項指標,從選材、設計結構、各系統性能方面確認是否適合制藥廠的生產工藝、便于安裝、維修保養、清洗、消毒等方面的要求,以滿足GMP的要求。
驗證項目 | 確認項 | 確認文件名稱 | |
DQ | 設計文件確認 | 設計圖紙 | 凍干機全套圖紙(干燥箱圖紙、平面布置圖、工藝流程圖、電器原理圖) |
部品表 | 材料配置表 |
表6-3
2)安裝確認(IQ):主要是指機器設備安裝后進行的各種系統檢查及技術資料的文件化工作。
IQ1(作為藥機廠需確認的內容):在公司進行安裝確認,確保機器各部件、系統按設計圖紙要求組裝,以達到設備的性能要求,保證設備調試運行正常。
IQ2(作為制藥廠需確認的內容):
1、 凍干機所提供技術資料的核查,(如設備、儀表、材料的合格證書、設備總圖、操作說明、安裝說明書、備品備件清單、產品裝箱清單等,)確認是否齊全,并根據所提供的資料對設備、備品備件的檢查驗收,檢查到貨與清單是否相符、是否與訂貨合同一致。
2、 設備的安裝檢查:設備的安裝位置是否合適,配套的公用工程、管路焊接是否光潔,所配備的儀表精度是否符合規定要求,安裝是否符合供方提出的安裝條件。
驗證項目 | 確認項 | 確認文件名稱 | |
IQ1 | 外購外協件 | 外購件進廠檢查 | 外購件檢驗記錄 |
箱體檢查(包括干燥箱、冷凝器) | 箱體檢驗記錄 | ||
電器柜檢查 | 電器柜檢驗記錄 | ||
廠內組裝 | 各主要系統管路檢查 | 過程檢驗記錄 | |
各系統組裝完成檢查 | |||
IQ2 | 現場安裝 | 隨機文件的確認 | 技術資料的檢查歸檔記錄 |
設備主要部件確認 | 設備主要部件檢查報告書 | ||
設備各系統完整性確認 | 設備各系統完整檢查報告書 | ||
公用工程檢查 | 公用工程配管報告書 | ||
現場施工工作確認 | 現場施工工作確認報告書 |
表6-4 安裝確認
3)運行確認(OQ):為證明設備或系統達到設定要求而進行的各種運行試驗及文件化工作。
安裝確認合格后再進行運行確認,按調試程序對機器進行調試后,按凍干機操作規程操作確認凍干機空載各項技術指標能否達到設定要求的一系列活動。
驗證項目 | 確認項 | 確認文件名稱 | |
OQ1 | 廠內運行 | 出廠前各項指標運行 | zui終檢驗記錄 |
OQ2 | 現場運行 | 計量器具檢定/校準 | 計量器具檢定報告 |
用戶方試運行檢查 | 現場試運行報告 | ||
操作規程培訓 | 現場培訓記錄 |
表6-5運行確認
4)性能確認(PQ):就生產工藝而言常指模擬生產試驗。
通過模擬生產考察凍干機運行的可靠性、主要運行參數的穩定性,證明凍干機是否達到設計標準和GMP有關要求而進行的系統性檢查和試驗。性能確認時至少應草擬好有關的標準操作規程和批生產草案,按草案的要求操作設備,觀察、調試、取樣并記錄運行參數。
在我公司(藥機廠)凍干機通常用水代替制品進行最大捕水量試驗。
在制藥廠根據產品的特點設計工藝運行條件,所用原料多數情況下可用替代品替代,且模擬生產至少應重復三次。但對于已使用過同類凍干機,且凍干機運行較穩定,人員已有一定同類設備實際運行經驗的生產線,也可跳過模擬生產,直接進行試生產。
驗證項目 | 確認項 | 確認文件名稱 | |
PQ1 | 模擬生產 | zui大捕水量測試 | 捕水量測試記錄數據、曲線 |
PQ2 | 模擬生產 | 凍干產品測試 | 運行記錄數據、曲線 |
表6-6 性能確認
5)產品驗證(PV):指在特定監控條件下的試生產。在試生產期間,為了在正式投入常規生產時能確有把握地控制生產工藝,往往需要抽取較多樣品,包括半成品及環境監控(必要時)的樣品,并需對試生產獲得的產品進行加速穩定性考察試驗。
除以上提到的驗證內容外,凍干機還有一些要求更加詳盡的驗證內容:如對凍干機滅菌效果的驗證;在位清洗驗證;氣體過濾器性能驗證;控制程序驗證;凍干曲線驗證等等,有關內容可參見相關資料。

上海拓紛廠家 www.toffon.cn
鮮馬奶作為一種富含營養的草原資源,不僅含有豐富的蛋白質、不飽
隨著凍干技術的發展,凍干機和冷凍干燥機已成為鹿茸加工的重要設
隨著中藥材加工技術的不斷進步,真空冷凍干燥技術逐漸成為提升三
菠菜含有豐富的維生素、鐵、胡蘿卜素等營養成分,對于血液、視力
傳統烘干胡蘿卜制品通常會因為加工時的高溫而導致其中的熱敏性營